La testosterona induce la liberación de una interleucina que paraliza la producción de los linfocitos responsables de la destrucción de la capa de mielina
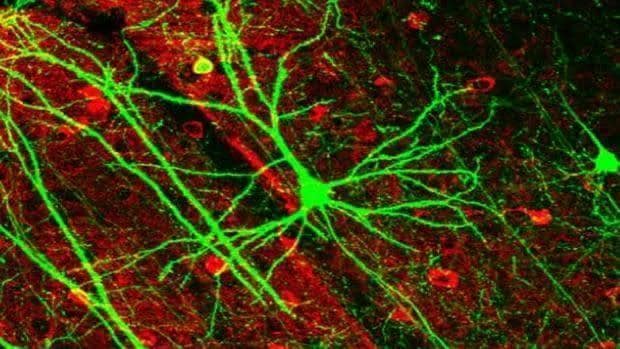
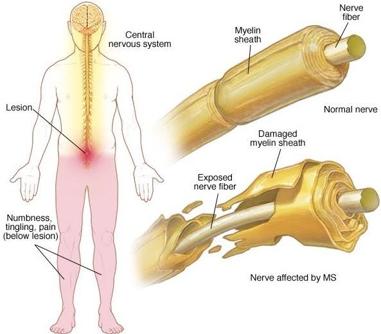
La esclerosis múltiple es una enfermedad neurodegenerativa causada por la destrucción por el sistema inmune del propio paciente de la capa de mielina que protege las neuronas. Una enfermedad que padecen cerca de 47.000 españoles –y hasta 2,3 millones de personas en todo el mundo–, muy especialmente las mujeres. Y es que como ocurre en la mayoría, sino todas, las enfermedades autoinmunes, la esclerosis múltiple es mucho más frecuente –entre tres y cuatro veces– en la población femenina. Pero, ¿a qué obedece esta diferencia de género? Pues según han sugerido distintas investigaciones, a la mayor concentración de testosterona de los varones. Y según muestra un nuevo llevado a cabo por investigadores de la Facultad de Medicina Feinberg de la Universidad Northwestern en Chicago (EE.UU.), efectivamente es así. Es más; los investigadores también han descubierto el porqué, abriendo así la puerta al diseño de nuevas terapias frente a esta devastadora enfermedad.
Como explica Melissa Brown, directora de esta investigación publicada en la revista «Proceedings of the National Academy of Sciences», «nuestro trabajo sugiere un mecanismo que explicaría la menor incidencia de esclerosis múltiple y otras enfermedades autoinmunes en los varones. Un hallazgo que podría abrir la puerta al desarrollo de un tipo de tratamiento totalmente novedoso para la esclerosis múltiple, lo que resulta muy necesario».
Benditos errores
El estudio parte de experimento previo en el que un alumno recién graduado no fue demasiado ‘virtuoso’ a la hora de separar por sexos a las crías de ratón que se iban a emplear en una investigación sobre la esclerosis múltiple. El resultado es que el trabajo, si bien diseñado para llevarse a cabo con hembras, se realizó con machos. ¿Y qué sucedió? Pues que los hallazgos fueron absolutamente sorprendentes. ¿La razón? La mayor concentración de testosterona característica de los machos de la mayoría de animales vertebrados –incluido el ser humano.
Así, el objetivo de la nueva investigación fue analizar por qué estos mayores niveles de testosterona parecen tener un efecto protector frente a la esclerosis múltiple. Y para ello, los autores utilizaron ratones macho. Esta vez a propósito.
Los resultados mostraron que la testosterona provoca que las células inmunes conocidas como ‘mastocitos’ liberen una interleucina, la IL-33, que actúa como ‘molécula guardiana’. Concretamente, lo que hace esta IL-33 es activar una serie de cascadas de reacciones químicas que previenen la producción de un segundo tipo de células inmunes, los linfocitos T colaboradores (Th17), que es directamente responsable del desarrollo de la esclerosis múltiple. Y es que son estos Th17 los que directamente atacan y destruyen la mielina.
Y llegados a este punto, ¿qué sucede en el caso de las hembras? Pues para averiguarlo, los autores emplearon ratones hembra –también a propósito– con esclerosis múltiple y vieron que, en comparación con sus homónimos masculinos, la respuesta inflamatoria de los Th17 era mucho más acusada, lo que provocó una mayor destrucción de la capa de mielina –tal y como sucede en el caso de las mujeres–. Pero también hay una muy buena noticia: esta respuesta inmune destructora se revertió con la administración de IL-33.
Como indica Melissa Brown, «dado que los niveles de testosterona son entre siete y ocho veces inferiores en las mujeres adultas que en los varones, creemos que las mujeres tienen unos niveles insuficientes para activar esta vía de protección. Sin embargo, hemos demostrado que la vía puede ser activada con la ‘molécula guardiana’ IL-33».
En este contexto, y además de la mayor incidencia en mujeres, la esclerosis múltiple presenta otras diferencias de género. Por lo general, las mujeres desarrollan la esclerosis múltiple a edades más tempranas y suelen padecer una forma remitente-recurrente de la enfermedad. Por su parte, la patología en los varones aparece en edades más avanzadas y suele ser más ‘progresiva’, empeorando con el paso del tiempo y sin periodos de remisión. Así, apuntan los autores, «el desarrollo de la enfermedad en varones también se correlacionaría con la reducción de los niveles de testosterona asociada a la edad».
Puerta a la esperanza
La mayoría de los fármacos disponibles para el tratamiento de la esclerosis múltiple actúan suprimiendo la actividad del sistema inmune, lo que conlleva numerosos efectos secundarios. Por tanto, es necesario contar, y con urgencia, con nuevos fármacos. Pero, ¿por qué no administrar testosterona? Pues porque si bien algunos estudios ‘pequeños’ han mostrado que el tratamiento durante 12 meses con esta hormona puede parcialmente revertir la destrucción de la mielina y, por ende, aliviar los síntomas en varones con la enfermedad, la administración de testosterona a largo plazo es, simplemente, inviable –tanto en varones como en mujeres–. Los efectos secundarios graves son demasiado numerosos. Quizás ha llegado el momento de centrarse en la IL-33.
Como concluye Melissa Brown, «nuestro trabajo ha identificado unas dianas moleculares y celulares novedosas y mucho más específicas que esperamos puedan conllevar al desarrollo de mejores terapias. Además, esta vía protectora mediada por la testosterona debería también ser investigada en otras enfermedades autoinmunes en las que, como sucede en la esclerosis múltiple, haya un sesgo femenino».